


 Français
Français
Understanding > Fundamental concepts > Observations IV
SPECTROSCOPY AND ANALYSIS OF LIGHT
(This section is written in French)
SPECTROSCOPIE ET ANALYSE DE LA LUMIERE
L'astronomie occupe dans le domaine des sciences une place unique due à une particularité qu'elle possède seule : il n'est pas possible d'agir sur l'objet que l'on étudie. On ne peut qu'observer. Et cette observation se fait par le biais d'un seul phénomène physique. Toute l'information que nous possédons sur l'univers qui nous entoure nous vient de la lumière que nous recevons (à quelques très rares exceptions près concernant les planètes du système solaire sur lesquelles des instruments automatiques ont été déposés).
Fort heureusement, avec la spectroscopie, nous disposons d'un outil
qui nous permet d'avoir accès à un grand nombre de paramètres
physiques.
Encore faut-il être capable de les mesurer avec toute la précision
nécessaire et, en particulier, être capable de discerner dans
ces mesures ce qui est significatif et imputable à l'objet observé
de ce qui est accidentel et imputable aux imperfections de nos instruments.
Comme toute science d'observation, l'astronomie est donc condamnée
à concevoir des instruments toujours plus performants.
La lumière
Précisons, en quelques mots ce qu'est la lumière. Les physiciens la désignent souvent sous le nom de "rayonnement électromagnétique". Rayonnement car, à partir de la source, la lumière se répand dans tout l'espace de façon uniforme. Et électromagnétique, car ce rayonnement est composé de deux grandeurs physiques, l'une qui est un champ électrique et l'autre un champ magnétique. Ces deux grandeurs sont inséparables dans la lumière et interagissent l'une sur l'autre en permanence, ce qui provoque l'oscillation - c'est donc une onde - et la propagation, à une vitesse très voisine de 300 000 km/s.
Comme tout phénomène ondulatoire, la lumière a une longueur d'onde. Il serait plus exact de dire qu'elle en a une infinité. En effet cohabitent dans la lumière toutes les longueurs d'onde comprises entre deux valeurs généralement assez éloignées l'une de l'autre et qui dépendent de la nature du phénomène responsable de l'émission. Ainsi, par exemple, dans la lumière visible, on trouve toutes les longueurs d'onde comprises entre 0,4 et 0,8 micromètre (millième de millimètre). Rappelons que la longueur d'onde est la distance parcourue dans l'espace par l'onde (ici, la lumière) pendant le temps d'une oscillation.
Du point de vue observationnel, la longueur d'onde a aussi une importance énorme car les techniques à mettre en oeuvre dépendent très fortement de ce paramètre. Cette dépendance concerne aussi bien le collecteur que le récepteur que l'on y associe. Indiquons, par exemple, pour bien faire saisir la chose, que le télescope classique à miroir poli associé à la plaque photo ou à des récepteurs plus modernes n'est utilisé que dans les domaines infrarouge, visible et ultraviolet. La radioastronomie a ses télescopes propres en forme de grande antenne métallique et utilise des récepteurs qui mettent en oeuvre les propriétés des micro-ondes. Enfin des instruments très particuliers ont dû être inventés pour les domaines des longueurs d'onde les plus petites. Il en va de même des récepteurs que l'on place derrière ces télescopes.
| Longueur d'onde | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Rayons gamma | < 0,1 nanomètre | ||||||||
| Rayons X | 0,001 à 100 nanomètres | ||||||||
| Ultraviolet extrême | 0,01 à 0,1 micromètre | ||||||||
| Ultraviolet optique | 0,1 à 0,4 micromètre | ||||||||
| Visible | 0,4 à 0,8 micromètre |
|
|||||||
| Infrarouge optique | 0,8 à 14 micromètres | ||||||||
| Infrarouge lointain | 0,014 à 0,1 millimètre | ||||||||
| Ondes herziennes millimétriques, micro-ondes | 0,1 à 3 centimètres | ||||||||
| Ondes radio, hyperfréquences | > 1 centimètre |
Qu'est-ce qu'un spectre ?
La lumière reçue sur Terre étant composée d'un grand nombre de longueur d'ondes différentes, il importe de les séparer pour les mesurer et en déduire la nature physique du corps qui l'a émise. Dans le cas de la lumière visible, nous allons utiliser le phénomène de réfraction qui a lieu lorsque la lumière passe d'un milieu à un autre. Lors de ce passage (par exemple le passage de l'air à l'eau ou du vide à l'air), un rayon lumineux est dévié d'un angle d'autant plus grand que sa longueur d'onde est courte. Pour que le phénomène soit bien observable, il faut que les deux milieux soient très différents (air et verre) et que le phénomène soit amplifié. Ce phénomène a lieu naturellement quand se produit un arc-en-ciel. La lumière blanche du Soleil (composée de toutes les longueurs d'onde, c'est-à-dire de toutes les couleurs) est séparée en une infinité de rayons ayant chacun une longueur d'onde bien définie que notre oeil voit sous forme de couleurs différentes. Cette décomposition de la lumière blanche est appelée le spectre visible qui va du violet au rouge.
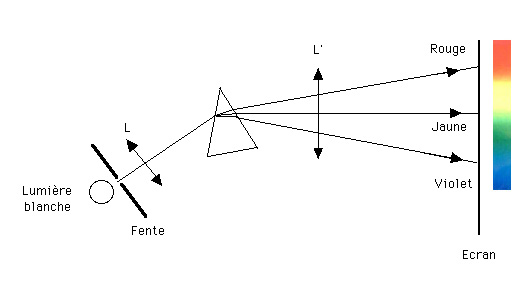
La visualisation du spectre de la lumière blanche
Voyons, grâce au schéma ci-dessous, comment on peut visualiser ce spectre. Une fente fine, placée au foyer d'une lentille L, est éclairée par une source de lumière blanche. Après passage sur l'arrête du prisme l'ensemble des rayons est projeté, à l'aide d'une lentille L', sur un écran. Sur l'écran on observe une infinité d'images de la fente, chaque image étant d'une couleur très légèrement différente de celle de sa voisine.
Schéma du spectrographe à prisme :
Un spectre modifié : l'absorption par un gaz
Derrière la fente plaçons une cuve transparente contenant un gaz de telle sorte que la lumière traverse la cuve sans être déviée. Sur l'écran on constate alors qu'à l'emplacement de certaines images de la fente, il n'y a plus de lumière. Ces raies noires (sans lumière) sont appelées des raies d'absorption. La lumière provenant de la source a été absorbée par le gaz contenu dans la cuve et ceci pour certaines longueurs d'onde seulement.
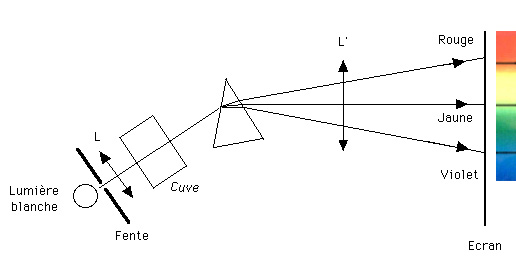
Nous sommes donc en présence d'une INTERACTION entre la matière et le rayonnement, qu'il va falloir expliquer. L'observation de raies noires permet de remonter à la nature du gaz traversé par la lumière : c'est ainsi que la lumière qui nous vient du ciel nous dévoile la composition chimique des milieux traversés.
Comment les choses se passent-elles ?
Considérons comme exemple, l'atome d'hydrogène et voyons comment ces raies peuvent se produire.
Les niveaux d'énergie :
L'atome d'hydrogène :
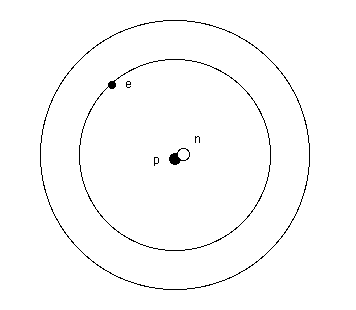
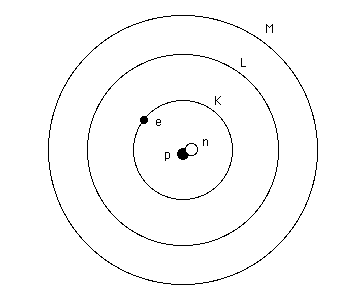
Bien que l'atome d'hydrogène ne possède qu'un électron,
il possède néanmoins tous les niveaux K, L, M, N, 0, P et
Q. Ceux-ci sont simplement inoccupés.
Ces niveaux sont des NIVEAUX D'ENERGIE. Ils ne peuvent être occupés
que par des électrons dont l'énergie (énergie cinétique
+ énergie électrique) est rigoureusement égale à
celle du niveau. Les énergies des niveaux vont en croissant au fur
et à mesure que l'on s'éloigne du noyau.
Pour passer du niveau K (appelé fondamental) au niveau L, l'électron
devra donc recevoir exactement la quantité d'énergie correspondant
à la différence E(L)-E(K).
Remarquons, que s'il reçoit la différence E(M) - E(K), il passera alors directement du niveau K au niveau M. On pressent déjà quelle analogie avec la structure complexe des spectres cela suggère. Rien d'étonnant, puisque c'est pour expliquer la formation des raies spectrales que ceci a été supposé, puis confirmé.
Les raies spectrales en absorption
Quel phénomène invoquer pour établir une relation entre les raies spectrales et les niveaux d'énergie dans l'atome ? Il revient à M. Planck d'avoir trouvé la solution.
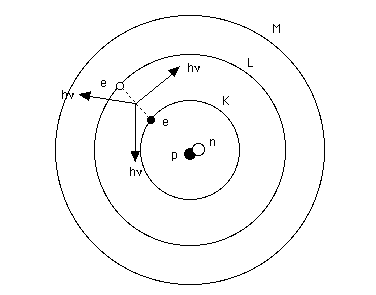
L'électron est normalement sur l'orbite K. S'il a été
entraîné sur une autre orbite (M, N, etc) par une excitation
quelconque, il retombe rapidement sur le niveau K. Ce passage de l'électron
d'un niveau supérieur au niveau K est accompagné d'une émission
lumineuse dont la fréquence est telle que la différence des
énergies entre les 2 niveaux concernés E(M) - E(K) = hv
Revenons à notre cuve et considérons un atome du gaz
de celle-ci.
Si un atome absorbe une radiation lumineuse de fréquence v
(telle que ΔE = hv) l'électron passera de l'orbite K à une orbite d'énergie supérieure.
Cet électron retombera rapidement sur K en réémettant
une radiation lumineuse de même fréquence que celle qui avait
arraché l'électron du niveau K. Mais cette émission
aura lieu dans toutes les directions. Dans la direction d'observation (l'écran)
il y aura donc beaucoup moins de lumière que si la radiation n'avait
pas été absorbée. Ce défaut d'énergie
se traduit par les raies plus ou moins sombres que l'on observe sur l'écran.
Les spectres de la très grande majorité des gaz sont
constitués de très nombreuses raies (souvent des milliers).
Pour un gaz donné, pris dans les mêmes conditions de température
et de pression, les raies que l'on observe se situent toujours aux mêmes
longueurs d'onde. Par contre pour deux gaz différents, quels qu'ils
soient, les raies seront toujours différentes.
Première conséquence : de l'examen d'un spectre
on peut identifier le gaz responsable du spectre. Les raies sont la signature
du gaz.
Par contre l'aspect des raies dépend des conditions dans lesquelles
se trouve le gaz.
Deuxième conséquence : on peut connaître, par l'étude des raies d'un spectre les conditions physiques dans lesquelles se trouve le gaz.
Encore faut-il avoir compris comment les choses se passent pour en tirer
des conclusions chiffrées.
En étudiant des centaines de spectres, Rydberg montra que la
position des raies est parfaitement définie par la formule suivante :
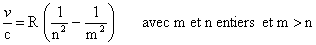
La présence de nombres entiers dans une formule permettant de calculer une fréquence (donc une longueur d'onde) était très surprenante. Pourquoi la fréquence v ne pouvait-elle pas varier de façon continue ?
Il y a 2 choses à expliquer.
-Pourquoi les niveaux d'énergie dans l'atome ne peuvent prendre
que certaines valeurs ?
-Quel processus invoquer pour établir une liaison entre les
raies observées et les niveaux d'énergie ?
La solution de Planck
En 1901, M. Planck fait l'hypothèse que l'énergie ne peut
pas varier de façon continue. Les échanges ne peuvent se
faire que par multiples d'une quantité élémentaire
(le quantum d'énergie) qu'il désigne par la lettre h et dont
il calcule la valeur :
h = 6,62 .10-27 J.s
La lumière ne peut donc échanger de l'énergie avec
la matière que par paquets (les photons) selon la formule :
E = h.v où E est l'énergie, h la
constante de Planck et v la fréquence de la lumière.
On admettait généralement que l'atome devait ressembler
à notre système solaire avec un noyau central contenant la plus grande
partie de la masse de l'atome, noyau autour duquel devaient tourner des
électrons qu'il était possible d'arracher de l'atome dans
certaines circonstances (phénomènes électriques).
Niels Bohr établit en 1913 le premier modèle d'atome
approchant la réalité. Il calcule des trajectoires circulaires
en appliquant la loi de Coulomb et en imposant la condition que l'énergie
de l'électron sur cette trajectoire soit un multiple de la constante
de Planck (quantification des trajectoires). Il trouve alors que l'électron
ne peut se déplacer que sur quelques trajectoires stables correspondant
à différentes valeurs de l'énergie (niveaux d'énergie).
Il nomme ces niveaux d'énergie K, L, M, N, O, P et Q. Ce modèle
d'atome rend parfaitement compte des raies observées dans le spectre
de l'hydrogène.
Remarque : la complexité des calculs pour les autres atomes
qui possèdent plus d'un électron ne permit pas de vérifier
que ce modèle était également valable pour les autres
corps. Il a fallu attendre la venue des ordinateurs pour entreprendre cette
vérification.
En attendant, et grâce aux progrès des techniques spectroscopiques,
de nombreuses améliorations durent être apportées au
modèle de Bohr pour rendre compte des nouvelles observations faites
(rotation de l'électron sur lui-même -spin-, trajectoires
elliptiques, précession des trajectoires). Les modèles actuels
font appel à la mécanique quantique.
Les choses sont alors simples. Un photon (de lumière) -dont la fréquence est telle qu'il peut faire passer un électron du gaz de la cuve du niveau K au niveau L- est absorbé par le gaz. Un électron passe du niveau K au niveau L. L'électron sur le niveau L ne peut y rester très longtemps. Il redescend donc sur le niveau K en réémettant un photon (c'est-à-dire de la lumière à la même fréquence que celle qui a été absorbée). Mais cette lumière est réémise dans toutes les directions. Dans la direction de l'écran, il n'y en aura qu'une infime partie, donc un défaut de luminosité qui se traduira sur l'écran par une raie plus ou moins sombre.
L'hypothèse de Planck généralise la discontinuité en physique
- La matière est discontinue : les atomes
- L'électricité est discontinue : les électrons
- L'énergie est discontinue : les quanta
- La lumière est discontinue : les photons
Les raies en émission
L'exemple ci-dessus concernait un gaz n'émettant aucune lumière propre. Dans l'univers, on rencontre des gaz qui émettent leur lumière propre (des plasmas) et un rayonnement émis par un tel gaz va voir son spectre également être modifié mais les raies sombres du spectre d'absorption vont devenir les seules raies brillantes du spectre en émission. Par exemple, le gaz néon excité va émettre une lumière où seules les raies rouges seront présentes. Les observations astronomiques montrent qu'en général, émission et absorption se mêlent et donnent des spectres très complexes.
Décalage d'un spectre : l'effet Doppler
Cet effet se manifeste lorsque l'onde émise et l'observateur sont en mouvement l'un par rapport à l'autre et dans la direction de propagation de l'onde :
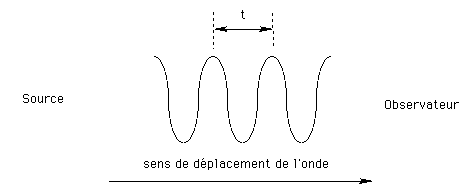
L'observateur à l'arrêt voit passer 2 maxima consécutifs à chaque intervalle de temps t. S'il s'approche de la source de rayonnement, ce temps sera plus court. L'onde se manifestera avec une fréquence plus élevée, donc une longueur d'onde plus courte. Inversement, s'il s'éloigne de la source il affirmera que l'onde a une plus grande longueur d'onde que lorsqu'il était immobile par rapport à la source. Cet effet, impossible à observer directement dans la vie courante à cause de la très grande vitesse de la lumière, est, par contre tout à fait observable dans le cas des ondes acoustiques.
Les conséquences de l'effet Doppler sur les raies spectrales
De ce que nous avons dit précédemment sur la formation des raies nous devrions conclure que celles-ci sont infiniment minces. En fait il n'en est rien comme le montre l'observation.
La forme d'une raie (observable si l'on trace la courbe d'intensité dans la direction de la dispersion) est une conséquence directe de l'effet Doppler. Les raies sont formées par l'absorption du rayonnement par des milliards d'atomes. Ces atomes du gaz sont animés de mouvements désordonnés extrêmement rapides (mouvement brownien). Certains de ces atomes s'approchent donc de l'observateur, tandis que d'autres s'en éloignent. Ceux qui s'approchent créent une raie infiniment fine décalée vers les plus courtes longueurs d'onde tandis que ceux qui s'en éloignent créent une raie décalée dans le sens opposé. Le résultat est un profil de raie montré ci-après.
Profil d'une raie spectrale
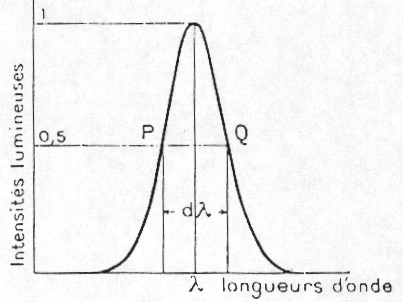
La courbe ci-dessus est le profil d'une raie. On parle aussi de profil naturel. La distance PQ, à mi-hauteur du profil, est la largeur naturelle de 1a raie. La partie centrale est le centre de la raie et les 2 parties de faibles intensités, les ailes de la raie. La valeur au centre est l'intensité de la raie.
Remarque : pour être cohérent avec ce que nous avons vu précédemment, il conviendrait de renverser la figure de façon à avoir une raie d'absorption. La valeur 1 mentionnée sur la courbe devrait alors être remplacée par une valeur comprise entre 0 et 1. 0 correspond à l'absorption totale au centre de la raie et 1 à une absorption nulle (en dehors de la raie).
L'étude des profils des raies spectrales des spectres stellaires ou galactiques est un objet fondamental de l'astrophysique. En effet, de très nombreux phénomènes physiques modifient le profil des raies. Si nous sommes capables de mesurer avec précision, l'intensité d'une raie stellaire en chaque point de celle-ci, nous aurons alors accès à des grandeurs physiques nous renseignant sur les conditions physiques à l'intérieur de l'étoile.
La mesure du profil d'une raie est un problème difficile pour
plusieurs raisons.
Les raies sont souvent très faibles car la lumière (faible)
des étoiles et surtout des galaxies est étalée sur
tout le spectre. En chaque point on ne dispose donc que d'une infime partie
de la lumière qui entre dans le spectrographe.
La courbe bien "lisse" présentée ci-dessus est une courbe
théorique. Dans la réalité, cette courbe est affectée
par le bruit engendré par l'atmosphère et tous les éléments
optiques forcément imparfaits que le rayonnement rencontre avant
d'arriver sur le détecteur et par le détecteur lui-même.
Des variations importantes de certains paramètres physiques
peuvent parfois entraîner des différences infimes dans le
profil des raies.
Qu'observe-t-on ?
La lumière du Soleil
Le Soleil est une énorme boule gazeuse dont la densité, par suite de la pression exercée par le poids des couches supérieures, augmente au fur et à mesure que l'on se rapproche du centre. Sous l'effet de cette pression, la température croît pour atteindre, au centre, des températures de l'ordre de quelques millions de degrés. De telles températures provoquent le phénomène de fusion nucléaire qui transforme successivement l'hydrogène en hélium, puis l'hélium en lithium, etc... La fusion s'accompagne d'un flux de rayonnement considérable. Cette énergie se propage de proche en proche à travers la couche convective jusqu'à la photosphère.
La photosphère est une couche extrêmement mince et froide
(pour le Soleil elle mesure 12000
La lumière des planètes
Les planètes ne sont pas censées avoir une émission propre de lumière (du moins dans le spectre visible) : elles réfléchissent la lumière du Soleil directement si elles n'ont pas d'atmosphère ou après avoir subi une transformation due à l'interaction avec les molécules du gaz atmosphérique dans le cas contraire. Le spectre résultant nous permet d'accéder à quelques paramètres de cette atmosphère.
Les paramètres que l'on peut mesurer dans le spectre observé
- La mesure de la température
par la détermination du profil de la fonction de Planck
- L'identification des éléments
par la mise en évidence des raies propres à chaque corps
- La détermination des abondances
par la mesure de l'intensité des raies d'un élément par rapport aux autres
- La mesure de la pression dans la zone absorbante
par la mesure de l'élargissement des raies de l'ensemble des éléments présents
- L'existence d'un champ électrique et sa mesure
par l'observation du dédoublement des raies de l'Hydrogène (effet Stark).
- La mise en évidence d'une rotation de l'étoile observée sur elle-même
par l'inclinaison des raies de l'ensemble de son spectre (effet Doppler).
Le fait que l'étoile observée s'éloigne de nous
par le déplacement vers le rouge de toutes les raies du spectre (effet Doppler).
Cette dernière propriété, appliquée aux
galaxies lointaines, a permis de mettre en évidence l'expansion de l'Univers.
On a pu, alors, établir une classification des étoiles en se basant à la fois sur leur température et sur les particularités de leurs spectres.
Crédit : L. Vapillon, J.E. Arlot/observatoire de Paris



